Gás e Vapor
A principal diferença entre gás e vapor está em sua temperatura crítica. O vapor é a matéria em seu estado gasoso, que pode ser liquefeito com o aumento da pressão. Já com o gás, isso não ocorre. Ele consiste em um fluido impossível de ser liquefeito com um simples aumento de pressão.
Comportamento dos Gases
Para saber se uma substância no estado gasoso é um gás, verifique a temperatura crítica. Se a sua temperatura for superior à temperatura crítica, ela é um gás. Já se a temperatura for igual ou inferior à temperatura crítica, a substância é vapor.
Os gases reais, como, por exemplo, o hélio, o nitrogênio e o oxigênio, possuem características moleculares diferentes e particulares de cada um. Porém, se forem todos colocados em altas temperaturas e baixas pressões, eles passam a apresentar comportamentos muito semelhantes. No estudo dos gases, adota-se um modelo teórico, simples e que não existe na prática, com comportamento aproximado ao dos gases reais. Essa aproximação é melhor quanto menor for a pressão e maior a temperatura. Esse modelo de gás é chamado de gás perfeito.
Por volta dos Séculos XVII e XIX, os cientistas Jacques Charles, Louis J. Gay-Lussac e Paul E. Clayperon, após analisarem o comportamento dos gases, elaboraram as leis que regem o comportamento dos gases perfeitos. Elas estabelecem as regras do comportamento “externo” do gás perfeito, levando em conta apenas as grandezas físicas que estão associadas a eles, que são volume, temperatura e pressão.
Lei geral dos gases perfeitos
A fórmula que determina a lei geral para os gases perfeitos pode ser vista da seguinte forma:
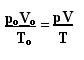
Em que po, Vo e To são respectivamente a pressão inicial, volume inicial e temperatura inicial. Essa fórmula é utilizada para quando as variáveis de um gás apresentarem variações.
Lei de Boyle
O físico e químico Robert Boyle determinou a lei que rege as transformações sofridas por um gás, quando sua temperatura é mantida constante. Essa lei diz que quando um gás sofre uma transformação isotérmica, a pressão dele é inversamente proporcional ao volume ocupado. Dessa lei obtemos que, como To = T, temos que:
poVo = pV
Lei de Charles
A lei de Charles é a lei que dita as transformações de um gás perfeito com seu volume constante. Essas mudanças são chamadas de transformações isocóricas ou isométricas. Segundo essa lei, quando uma massa de gás perfeito sofre transformação isocórica, a sua pressão é diretamente proporcional à sua temperatura absoluta. Matematicamente, essa lei pode ser expressa com a seguinte fórmula:
![]()
Onde po e To são respectivamente a pressão inicial e a temperatura inicial.
Lei de Gay-Lussac
A lei de Gay-Lussac é a lei que determina as mudanças sofridas de um gás perfeito à pressão constante. Apesar de levar o nome de Gay-Lussac, essa lei já havia sido descoberta pelo físico e químico A.C. Charles. Segundo a lei, ao sofrer uma transformação isobárica, o volume do gás é diretamente proporcional à sua temperatura absoluta. Matematicamente essa lei pode ser expressa da seguinte forma:
![]()
Onde Vo e To correspondem respectivamente ao volume inicial e à temperatura inicial.
Aprendeu? Acompanhe nosso blog para mais resumos, mapas mentais e dicas de estudo!









